组装纳米材料的独特结构和生物学效应使其在生物医学领域的应用受到了广泛关注和认可。纳米材料在复杂生命体中的传递过程中会遇到不同的生物界面,使得本质上处于动态平衡的组装纳米材料的结构和性质发生改变。为了实现组装纳米材料可靠而精准的生物医学应用,科学家们通常着力于超高稳定的组装纳米材料的制备;同时,也可以利用生物界面去调控纳米材料的组装,使纳米材料变得更加“智能”。
基于调控组装的理念,国家纳米科学中心王浩课题组致力于发展活体原位自组装新型生物纳米材料,近年来取得了一系列进展。他们开发了一系列多肽类和荧光分子类的组装模块,利用特殊的组装发光分子模块进行活体组装调控的“观察”。辅以电子显微镜,对组装纳米颗粒调控形成纤维进行了系统研究,发现氢键是转化的内驱力,通过亲疏水平衡、给受体相互作用可以调控组装。他们利用体内酸碱度,在特定肿瘤部位实现组装调控构筑药物递送“主体”,并高效低毒的完成“两步法”给药(Adv. Mater. 2017, 29, 1605869)。同时,他们通过活体模板调控,将纳米颗粒转化纤维并构筑“人工细胞外基质”。人工构筑的细胞外基质形成肿瘤转移的屏障,从而实现了抑制肿瘤浸润和转移 (ACS Nano, 2017, 11, 4086–4096)。由于多肽组装调控方面系统而有特色的工作,他们受邀撰写了综述(Adv. Mater. 2018, 30, 1703444)。
最近,国家纳米科学中心王浩研究员、王磊研究员和东北师范大学张景萍教授通过调控多肽聚合物与阿尔兹海默相关的Aβ淀粉样蛋白的组装,使Aβ进入细胞内部。并同时通过激活细胞自噬,利用细胞自身降解Aβ,降低了Aβ的神经毒性,提高了阿尔兹海默症老鼠的记忆力。相关研究成果被(Nature Communications, 2018, DOI:10.1038/s41467-018-04255-z)接收;该工作已申请中国发明专利(专利申请号:CN2017028528.X)。该工作由罗强、林耀新和杨培培(共同第一作者)共同完成,罗强同学负责材料的制备,林耀新同学负责生物实验,杨培培助理研究员负责材料的性质测试。
清除Aβ可能是治疗阿尔兹海默症的一种有效手段。目前设计的药物可以延缓Aβ的聚集,但是临床效果并不是很满意。众多的实验表明有效的清除Aβ淀粉样蛋白是治疗的关键点之一。王浩研究团队报道了一种多肽-聚合物纳米材料(即纳米清道夫),具有捕获和清除Aβ的功能。首先,通过尾静脉注射清道夫可以通过血脑屏障到达病灶部位,通过疏水和氢键作用与Aβ形成共组装体,实现了对Aβ的高效捕获;进而携载Aβ的纳米清道夫可以大量进入细胞并激活细胞自噬机制,利用细胞降解Aβ,从而有效的清除Aβ并降低神经毒性。最后在治疗阿尔兹海默症转基因老鼠模型中,发现老鼠脑部的Aβ斑块显著降低,并且水迷宫实验结果显示老鼠的记忆力得到了有效的恢复。纳米清道夫有望成为治疗阿尔兹海默症的一种有效方法。
该研究得到了国家自然科学基金、国家杰出青年科学基金、基金委创新群体项目、中科院国际合作、交叉团队等项目的支持。
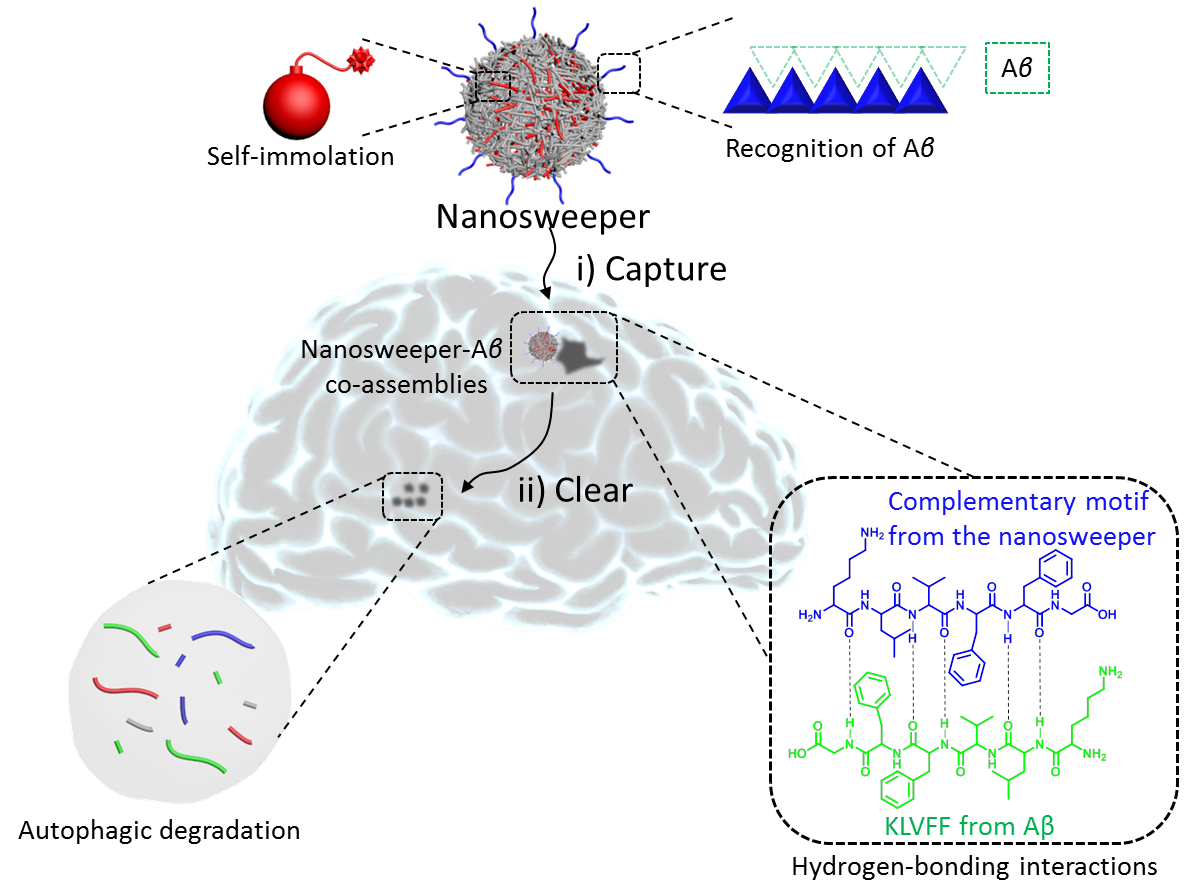
图:纳米清道夫的工作机理。纳米清道夫通过共组装捕获Aβ,并将其携载入胞,进而激活细胞自噬有效地降解Aβ。

