肿瘤治疗的传统策略,是针对一般的肿瘤细胞。近年肿瘤生物学的研究表明,肿瘤干细胞才是导致癌症复发、转移及化疗和放疗耐药的根源,从而为肿瘤的诊断和治疗提供了崭新的思路。为此,寻找能有效靶向杀伤(“狙击”)肿瘤干细胞的方法与药物,有望成为人类攻克肿瘤的新希望。
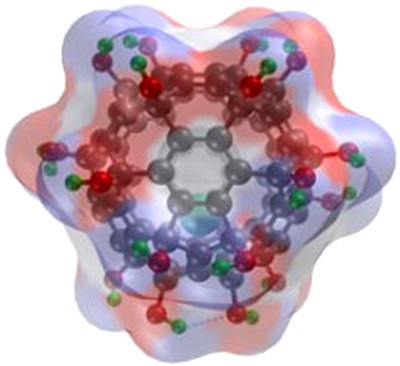
最近,中科院纳米生物效应与安全性重点实验室(中科院高能物理研究所/国家纳米科学中心)和中科大生命学院的合作研究发现,金属富勒醇Gd@C82(OH)22 碳纳米材料可以高效抑制三阴性乳腺癌干细胞的自我更新能力,Gd@C82(OH)22通过调控肿瘤微环境阻断细胞从上皮样(EMT)到间质样(MET)的转换,实现高效清除肿瘤干细胞,终止肿瘤的发生和转移。研究者巧妙利用Gd@C82(OH)22在肿瘤表面的富氧微环境(丰富的肿瘤新生血管)和肿瘤深部的缺氧微环境中的去质子化和质子化的转变,实现对肿瘤干细胞的“狙击”作用和更高效的乳腺癌症治疗效果(研究成果发表在Nature Communications, 2015, 6, 5988)。
尤其重要的是,实验结果显示,Gd@C82(OH)22对正常干细胞没有作用和毒性。迄今为止发现的肿瘤干细胞抑制药物的高毒性,是限制其临床应用的关键问题。与此相反,体内体外的实验结果证明,Gd@C82(OH)22 碳纳米物质没有可观测的毒性。它因此成为可以直接靶向肿瘤干细胞的无毒的肿瘤干细胞纳米抑制剂。
肿瘤干细胞本身与肿瘤细胞一样具有高度的异质性,传统的肿瘤干细胞抑制药物往往针对单个靶点,只能部分削弱而不能有效杀伤肿瘤干细胞,却还明显增加对正常干细胞的毒性。由于富勒醇纳米结构的独特物理化学性质,尤其是球体结构的表面的高度可调控性可以实现其多功能化,因此,它有可能实现同时针对多个靶点却不增加对正常干细胞的毒性,为肿瘤干细胞的临床治疗提供了实用的新的途径。
传统的肿瘤放疗和化疗的基本原理是“杀死”肿瘤细胞,也杀死正常细胞,因此,其毒副作用也成为导致肿瘤治疗失败的要因之一。2005年中科院高能所的研究者发现了低毒性碳纳米物质“不杀死”肿瘤细胞,也能高效抑制肝癌的生长。在随后的系统研究中,他们提出了“监禁”肿瘤细胞的新策略,并通过设计纳米表面筛选出Gd@C82(OH)22,在动物身上验证了“监禁”肿瘤的思路。最近的机制研究揭示了这个策略可以避免肿瘤细胞的抗药性(美国科学院院刊PNAS 2010),高效抑制肿瘤的转移并超越传统药物分子与靶分子作用的化学原理(美国科学院院刊PNAS 2012),并且高效抑制肿瘤干细胞的自我更新能力,终止肿瘤的发生和转移(Nature Communications 2015)。通过十年多的研究显示,这些治疗效果的实现都与Gd@C82(OH)22对肿瘤微环境(肿瘤生长的“土壤”)的直接调控密切相关,而肿瘤干细胞被认为是肿瘤复发的“种子”。
在过去10年多的研究中,该工作先后得到了国家自然科学基金委,科技部,中科院先导专项,北京市科委,中科院高能所的支持。